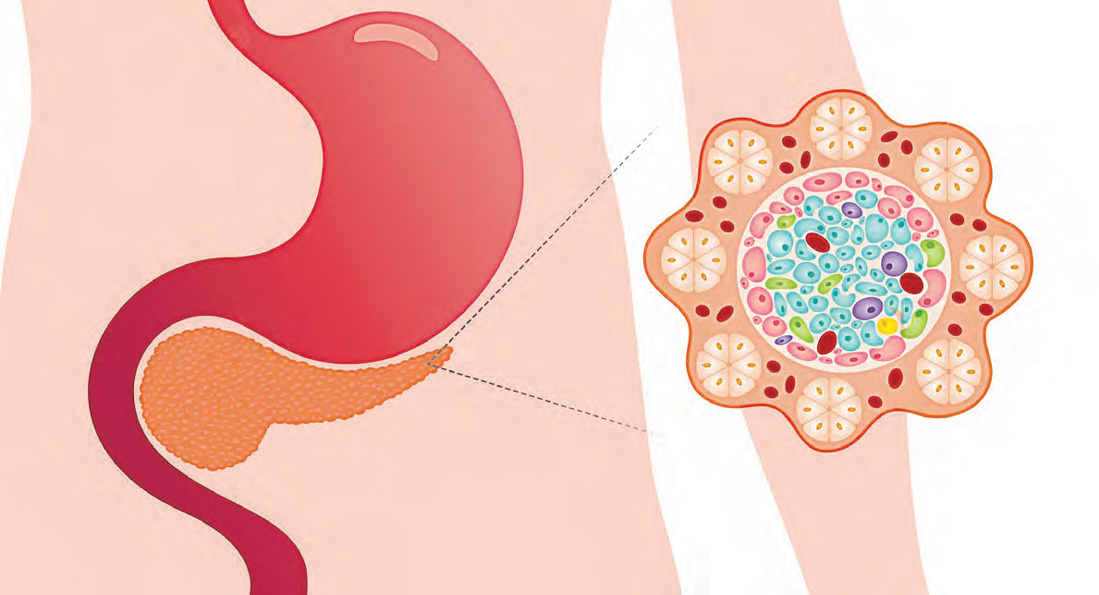
أين تقع جزر لانجرهانز تحديدًا؟ هل هي موجودة في المحيط الهادي أو الهندي أو حتى الأطلنطي؟ القارئ لهذه الجملة للوهلة الأولى يتصور أنها توجد على الأرض، وأنها عبارة عن بقعة ترابية موجودة في أحد البحار أو المحيطات، لكن الذي يمتلك خلفية ثقافية أو معلومات ذات علاقة بجسم الإنسان، سيعرف أنها عبارة عن عدة مجموعات صغيرة من خلايا بنكرياس معظم الفقاريات، تتواجد على شكل بقع مختلفة من حيث الشكل، وكذلك الوظيفة مقارنةً بالخلايا الأخرى الموجودة على نفس الغدة، لذلك أطلق عليها اسم “الجزر”، وتشكّل ما يتراوح ما بين واحد إلى اثنين بالمئة من الكتلة الكلية للبنكرياس، أما كتلتها منفردة فتقدّر بحوالي واحد ونص غرامًا، ويبلغ عددها عند الشخص البالغ حوالي مليون جزيرة، ويبلغ قطر الواحدة منها 0.2 ملليمترًا. ويمكن تمييزها بسهولة عن أنسجة البنكرياس الأخرى، لأنها معزولة بواسطة نسيج ليفي رفيع القطر، وتتركز في الأوعية الدموية على شكل عناقيد صغيرة. ويُعزى سبب تسمية جزر لانجرهانز بهذا الاسم إلى اسم مُكتشفها، وهو الطبيب الألماني “بول لانجرهانز” الذي وصفها لأول مرة، وكان ذلك في عام 1869م. وتعرف جزر لانجرهانز بأنها الأنسجة المنتجة للإنسولين.
خلايا جزر لانجرهانز
هناك مجموعة مختلفة من الخلايا التي تنتمي لجزر لانجرهانز، تختصّ كل منها بإنتاج نوع محدد من الهرمونات، وهذه الخلايا هي:
خلايا بيتا: وهي النوع الأكثر شيوعًا، وتقوم بإنتاج هرمون الإنسولين، الذي يعد الهرمون الرئيس في عملية تنظيم التمثيل الغذائي للكربوهيدرات، والدهون، والبروتين، كما يعزز امتصاص واستقلاب الجلوكوز بواسطة خلايا الجسم، وترتبط عدم قدرة هذه الخلايا على إنتاج الإنسولين، أو فشلها في إنتاج كميات كافية منه بمرض السكري بشكل مباشر.
خلايا ألفا: تنتج هرمونًا معاكسًا لهرمون الإنسولين، وهو هرمون الجلوكاجون، الذي يقوم بإطلاق الجلوكوز من الكبد، إضافة إلى الأحماض الدهنية من الأنسجة الدهنية.
خلايا دلتا: تنتج هذه الخلايا هرمون السوماتوستاتين، الذي يعد مثبطًا قويًّا للسوماتوتروبين، والأنسولين، والجلوكاجون، ومع ذلك، فإن دوره في عملية تنظيم التمثيل الغذائي ليس واضحًا بعد.
خلايا بي بي: تقوم هذه الخلايا بإفراز ببيتيدات البنكرياس.
خلايا إبسيلون: وتقوم بإفراز مادة يطلق عليها اسم جريلين.
وتُعتبر جزر لانجرهانز، من الغدد الصماء التي لا تُطلق إفرازاتها في القنوات البنكرياسية، ولكن تفرز الهرمونات، مثل هرموني الإنسولين والجلوكاجون إلى مجرى الدم مباشرة، لتحافظ هذه الهرمونات على مستوى السكر (الجلوكوز) الملائم في الدم، ليستعمل الجسم بدوره السكر الموجود في الدم لإنتاج الطاقة. ومن الجدير بالذكر أن فشل خلايا جزر لانجرهانز في تصنيع الإنسولين، أو إنتاج كميات كافية منه للسيطرة على مستوى الجلوكوز في الدم من أسباب مرض السكري.
تَمكَّن فريق بحثي مصري مشترك من جامعتي زويل والمنصورة، من ابتكار وتطوير تركيبة جديدة من مادة السليمارين المستخلصة من الأعشاب باستخدام تقنيات النانو. التقنية الجديدة نجحت في خفض مستويات السكر في الدم لدى حيوانات التجارب المصابة بالسكري من النوع الثاني، مقارنةً بالمركب الطبيعي. ولا تقتصر فاعلية التركيبة الجديدة على تفعيل إفراز الإنسولين، ولكنها تمتد إلى تنشيط خلايا بيتا بجزر لانجرهانز المسؤولة عن إنتاجه.
اكتشاف الأنسولين
يحدث مرض السكري عندما يفشل البنكرياس في أداء عمله بشكل سليم، حيث إنه المسؤول الأول عن إبقاء السكر ضمن مستواه الطبيعي. فإن حدث خلل وفشلت خلايا البنكرياس في ذلك، فإن الإنسان معرّض للإصابة بمرض السكري.
لذلك يُعتبر مرض السكري من أبرز الاضطرابات المرتبطة بخلايا جزر لانجرهانز. وتعود البداية الحقيقية لاكتشاف الإنسولين إلى عام 1869، حينما تمكن طالب طبيب ألماني -وهو بول لانجرهانز- من اكتشاف خلايا في البنكرياس، اعتقد أنها تفرز مادة تعالج مرض السكر، وبعد إجراء بحوث عديدة على خلاصات البنكرياس استمرت حتى عام 1921، استطاع عالمان من جامعة “تورنتو” بكندا فصل خلايا البنكرياس التي تفرز هرمون الإنسولين الذي جرب على الحيوانات، ثم على مرضى السكر الذين استجابوا للعلاج. وكلمة “إنسولين” مشتقة من المصطلح اللاتيني (انسولا) ويعنى جزيرة، حيث تفرز الإنسولين جزر لانجرهانز البنكرياسية، فمعنى كلمة إنسولين إذن، هو “هرمون الجزيرة”. وقد أراد البعض ترجمة هذه الكلمة إلى اللغة العربية، فأطلق عليه اسم الجزيرين، ولكن الاسم الأصلي فرض نفسه على كل اللغات.
ومنذ اكتشاف الإنسولين عام 1921، لم تتحقق إنجازات تذكر في علاج مرض السكر المرتبط بالإنسولين حتى عام 1984، حيث تمكن العلماء -باستخدام الهندسة الوراثية- من تصنيع الإنسولين البشري الذي يتميز على الإنسولين الحيواني، الذي استخدم لأكثر من ستين سنة بعد اكتشافه، بقوة فعاليته وقلة أعراضه الجانبية. كما أن الإنسولين البشري قد حل مشكلة المرضى الذين كانوا يرفضون استعمال إنسولين الخنزير لأسباب دينية، ومشكلة المرضى النباتيين الذين أحجموا عن استعماله لأنه من أصل حيواني.
وفي أواخر القرن الماضي، أجريت بحوث استهدفت توصيل الإنسولين إلى الدم عن طريق الفم بدلاً من الحقن التي تمثل مشكلة لكثير من المرضى، وتشير النتائج إلى قرب تحقيق هذا الهدف. ولقد أفادت البحوث التي قدمت في مؤتمر الجمعية الأوروبية لدراسة مرض السكر، بإمكانية استعمال الإنسولين على هيئة بخاخات رئوية من المأمول أن يحقق استخدامها نجاحًا كبيرًا في علاج المرضى كبديل للحقن.
ومنذ سنوات، نشرت مجلة “ديابيتولوجيا” المتخصصة في دراسات السكر، بحثًا يفيد بإمكانية زرع كبسولات في أجسام الحيوانات المصابة بالمرض، تحتوي على الجزر البنكرياسية التي تفرز الإنسولين، ولقد حققت هذه الوسيلة نجاحًا ملموسًا في علاج المرض. كما يشير البحث، إلى إمكانية استحداث الخلايا التي تفرز الإنسولين باستخدام وسيلة الخلايا الجذعية، وهي وسيلة يمكن بواسطتها استحداث أعضاء أخرى لجسم الإنسان. وحينما تكتمل الجوانب الإكلينيكية لهذه البحوث، فإنه من المتوقع أن تكون من أهم إنجازات القرن الحادي والعشرين.
هذا هو الإنسولين الذي كان اكتشافه سببًا في منح جائزة نوبل في الطب مرتين؛ الأولى عام 1923 حينما منحت الجائزة لعالمين اشتركا في الإنسولين، والثانية عام 1934 وكانت للعالم الذي اكتشف علاج الأنيميا الخبيثة، واستحق الجائزة لذلك، وكان قد أصيب بالسكر قبل عام 1921، وقدر أنه سيموت خلال بضع سنين، ولولا اكتشاف الإنسولين الذي عولج به، لما عاش هذا العالم ليحقق اكتشافه الذي استحق من أجله جائزة نوبل.
جزر لانجرهانز وعلاج مرض السكري
تم تطور العديد من العلاجات لمرضي السكري من خلال أساليب مختلفة لابتكار طرق علاج جذري لمرض السكري، وذلك بتجديد خلايا البنكرياس عبر العديد من التقنيات الحديثة، مثل الخلايا الجذعية، أو الهندسة الحيوية، أو العلاج الجيني، وزراعة جزر لانجرهانز.
زراعة جزر لانجرهانز
يعتمد تجديد خلايا البنكرياس على معالجة الاختلال الوظيفي لخلايا بيتا المسؤولة عن إنتاج الجلوكوز بشكل طبيعي في الجسم، وهو الأمر الذي يفتقده مرضى السكري. ويتوقع الباحثون أن تجديد خلايا البنكرياس عبر العلاج الجيني وزراعة جزيرات لانجرهانز حلاًّ جزئيًّا لهذه المشاكل، حيث يمكن أن يكون وسيلة محتملة لتعزيز قدرة الجسم الطبيعية على تجديد خلايا بيتا. ونظرًا لأن هذا إجراء تجريبي، فإنه لا يمكن إجراء عملية زرع الجزر إلا كجزء من تجربة سريرية مسموح بها من قبل إدارة الغذاء والدواء الأمريكية. ويأمل الباحثون في أن زرع هذه الجزر سيساعد المصابين بداء السكري من النوع الأول في تحسين مستويات السكر في الدم، وخفض أو إزالة الحاجة إلى حقن الإنسولين، والتعرف بشكل أفضل على أعراض انخفاض السكر في الدم.
ومن أجل إتاحة إمكانية زراعة جزيرات لانجرهانز لمعظم مرضى داء السكري، يتوجب الحصول على مصادر كبيرة لجزر لانجرهانز، وكذلك التوصل لأساليب لتثبيط المناعة في جسم المستقبل بطرق أقل رفضًا بالنسبة للجسم، وذلك عبر حقن بروتينات جديدة قد تشارك في حماية الجزر من هجوم جهاز المناعة على الخلايا الجديدة.
وقد طور الباحثون نواقل توصيل الجينات الخاصة بالخلايا بيتا والغدد الخارجية، وهم يدرسون الآن التأثيرات العلاجية لتقليل رفض الجسم الزائد لخلايا البنكرياس، حيث تمت زراعة بنكرياس كامل لدى ما يزيد عن الـ20 ألف شخص حتى الآن، بينما تم زراعة جزر لانجرهانز لدى ما يقارب الألف شخص حتى الآن.
وقد يتمكن الباحثون من تأخير أو عكس أو منع ظهور مرض السكري من النوع الأول، حيث أظهرت النتائج الأخيرة أن توصيل البنكرياس لبروتين الاندماج الاصطناعي، يمكن أن يمنع تطور مرض السكري في الفئران المصابة بداء السكري.
ويركز الباحثون على إعادة تجديد خلايا بيتا البنكرياسية من الخلايا الجذعية، وإعادة إنشاء البيئة الخلوية الطبيعية لخلايا بيتا، حيث توفر الخلايا الجذعية المستحدثة ذات الهندسة الحيوية التي تعمل مثل الخلايا الجذعية الجنينية، الفرصة لتوليد خلايا جزيرة خاصة بالمريض. ونظرًا لنقص الأعضاء المعدة للزراعة مقارنة مع نسب حدوث مرض السكري، تستدعي الحاجة إيجاد مصدر غير محدود لجزر لانجرهانز. ويعد إنتاج خلايا بيتا البشرية من الخلايا الجذعية أو زراعة خلايا بيتا التي يكون مصدرها من الحيوانات، أحد الحلول الممكنة التي يمكن أن تلبي هذه الحاجة. ولكن تستلزم هذه الزراعة تطبيق بروتوكولات خاصة، بهدف جعل الجسم قادرًا على تحمل هذه الأنسجة الغريبة وحمايتها من النوبات المناعية.
ويمكن تطبيق أساليب ليتقبل الجسم الخلايا الجديدة، وذلك بمساعدة التقنيات الحديثة التي يمكن أن تساهم في إفراز الإنسولين داخل خلايا الكبد، من خلال حواسيب صغيرة جدًا تحتوي على مجسات داخل مضخات الإنسولين، التي تقوم بفحص مستويات السكر في الدم بشكل متواصل، وتقوم بتزويد الجسم بالإنسولين عند الحاجة للحفاظ على مستويات السكر طبيعية في الدم.